
Acqua dura e addolcimento dell’acqua
Ogni ménage e ogni fabbrica usano l’acqua e nessuna di essa sarà pura. Uno dei parametri di impurità che è di particolare interesse è la “durezza”. In questo caso si tratta della presenza degli ioni disciolti, principalmente del calcio Ca2+ e del magnesio Mg2+ che vengono presi attraverso il contatto con sassi e sedimenti presenti nell’ambiente. Le cariche elettriche positive di quegli ioni vengono bilanciate con la presenza di anioni (ioni negativi), di cui i più importanti sono il bicarbonato HCO3- e il carbonato CO32-. Tali ioni provengono dai sedimenti calcarei e anche dall’anidride carbonica che è presente in tutte le acque presenti nell’atmosfera e specialmente nelle acque sotterranee.
Origine della “durezza” dell’acqua
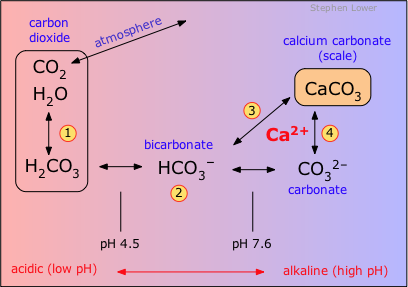
Il diossido di carbonio entra in reazione con l’acqua formando così l’acido carbonico (1) che al pH ambientale normale esiste principalmente nella forma dell’ione bicarbonato (2). Gli organismi marini microscopici consumano questo come carbonato (4) per formare scheletri calcarei che, nel corso di milioni di anni, hanno costruito depositi enormi di calcare. Le acque sotterranee che naturalmente sono leggermente acide a causa della presenza del CO2 (sia questa assorbita dall’aria, che quella prodotta dalla respirazione dei batteri del suolo) sciolgono il calcare (3), prendendo così gli ioni di calcio e di bicarbonato e successivamente diventando “dure”. Se la concentrazione dell’HCO3- è troppo alta, la combinazione dei processi (2) e (4) fa il carbonato di calcio (“il calcare”) depositarsi su superfici come l’interno dei tubi. (Il bicarbonato di calcio stesso non forma un solido, ma si deposita sempre come il CaCO3.)
Questi “ioni di durezza” causano due problemi principali. Prima di tutto, i cationi metallici entrano in reazione con i saponi, contribuendo così alla formazione di uno spiacevole precipitato — il ben conosciuto “anello della vasca da bagno”.
Ovvero, i carbonati di calcio e magnesio si depositano prevalentemente come solidi viscosi sulle superfici dei tubi e soprattutto sulle superfici degli scambiatori di calore delle caldaie. In conseguenza, l’accumulo di calcare può impedire il flusso dell’acqua nelle tubazioni. Nelle caldaie i depositi funzionano come isolanti termici che impediscono la portata di calore nell’acqua; questo non solo riduce l’efficienza del riscaldamento, ma anche surriscalda il metallo — il problema che può portare a guasti catastrofici nei sistemi sotto pressione.
Tipi di durezza dell’acqua
Durezza temporanea
Questa definizione si riferisce alla durezza le cui caratteristiche possono essere rimosse bollendo l’acqua in un recipiente aperto. Generalmente queste sono acque che scorrono attraverso le formazioni calcaree e contengono il bicarbonato HCO3- insieme alle piccole quantità del carbonato CO32- come i principali ioni negativi. La bollitura dell’acqua provoca la reazione
2 HCO3- → CO32- + CO2 + H2O
neutralizzando l’anidride carbonica. Il CO32- reagisce con gli ioni Ca2+ o Mg2+, formando gli insolubili carbonati di calcio e di magnesio che poi si depositano. Legando in questo modo gli ioni metallici, vengono significativamente ridotte le quantità necessarie per la formazione della schiuma di sapone.
Durezza permanente
Le acque che contengono altri anioni, come il cloruro o il solfato, non possono essere pulite attraverso bollitura, perciò si dice che sono dure “permanentemente”. L’unico trattamento efficace è rimuovere tutti gli ioni, normalmente con il metodo descritto in seguito.
Addolcimento dell’acqua convenzionale
Quasi tutti i convenzionali dispositivi per l’addolcimento dell’acqua sono basati sul processo conosciuto come scambio ionico in cui gli ioni di “durezza” si scambiano i posti con gli ioni di sodio e di cloruro che sono liberamente legati alla resina di scambio ionico o a una zeolite (molti minerali di zeolite si trovano nella natura, ma quelli speciali sono spesso artificiali).
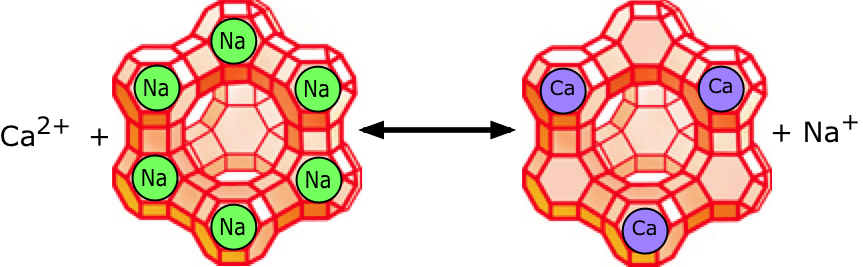
Il disegno mostra una zeolite caricata negativamente a cui sono attaccati gli ioni di sodio [positivi]. Gli ioni di calcio o di magnesio nell’acqua sostituiscono gli ioni di sodio che vengono spinti nell’acqua. In maniera simile, le zeoliti caricate positivamente legano gli ioni di cloruro (Cl-) caricati negativamente, che vengono sostituiti con gli ioni di bicarbonati nell’acqua. Quando le zeoliti si convertono nelle loro forme Ca2+ e HCO3-, perdono gradualmente la loro efficacia e devono essere rigenerate. Questo lo si può eseguire facendo passare una concentrata soluzione salina attraverso di loro, avviando così l’inversione della reazione descritta sopra. Però qui troviamo uno degli svantaggi di questo processo: la maggior parte del sale utilizzato nel processo di rigenerazione viene buttato dal sistema e di solito viene scaricato nel suolo o nel sistema di drenaggio — una cosa che può fare danni gravi all’ambiente, specialmente nelle zone aride. Per questo motivo, molte giurisdizioni divietano tali scarichi e costringono gli utenti allo smaltimento della salamoia utilizzata presso un sito attrezzato, oppure devono rivolgersi ai servizi commerciali.
Gli “alternativi” metodi di addolcimento dell’acqua
La grande importanza economica dell’addolcimento dell’acqua ha creato una grande e fiorente industria che utilizza una serie di metodi sicuri basati sugli approvati principi scientifici. Purtroppo, ha anche attratto una varietà dei produttori che offrono tecnologie che secondo loro sono migliori, meno costose, più facili da installare o “prive di sostanze chimiche”. Però tali tecnologie non sono mai state approvate scientificamente e i loro principi di funzionamento non possono essere adeguatamente spiegati dal punto di vista delle leggi della chimica. Questo non significa che tali schemi non possano funzionare (dopotutto, possiamo usare le conoscenze teoretiche per dimostrare che nelle condizioni idealizzate l’acqua non può mai bollire e non può mai piovere!), ma tutto questo dovrebbe provocare un buon colpo di scetticismo. La maggior parte del sostegno dei metodi alternativi di trattamento dell’acqua proviene da quelli che hanno un interesse commerciale in questi dispositivi. Non è basata sugli indipendenti, credibili e verificabili dati delle prestazioni, e le spiegazioni del funzionamento che presentano rivelano una bassa comprensione della chimica di base dalla parte dei loro autori, perciò è difficile avere molta fiducia di loro.
Contro questo, ci sono alcune prove aneddotiche a sostegno della versione che alcuni dispositivi magnetici ed elettromagnetici possono essere efficaci nella prevenzione della formazione di calcare nei sistemi di acque dure. È molto difficile giudicare queste affermazioni, perché sono quasi mai basate sui test descritti abbastanza bene per poter valutarle e verificare i risultati. Però, la mancanza delle prove “scientifiche” non dovrebbe mettere subito in dubbio l’efficacia di un dispositivo, dovrebbe far pensare prima di comiciare ad usarlo senza alcuna garanzia di risultato.
